有機超強塩基を用いる触媒的反応の開発
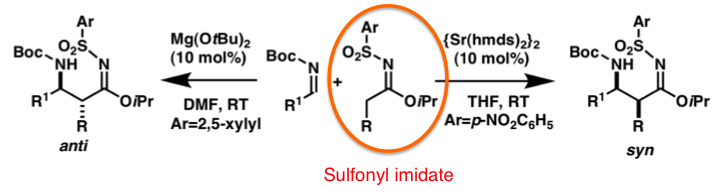
当研究室では新規な反応剤の開発も行っています。容易にケトンとスルホンアミドから調製することのできるスルホニルイミデートを新たな求核剤として開発を行った結果、種々の求電子剤と良好に反応し、高い収率、選択性で目的化合物を与えました。上の図においては、反応条件の違いによって生成物のジアステレオ選択性をコントロールできる興味深い例を示しています。また、硫黄の代わりにリン原子を含有するホスホニルイミデートの開発も達成しました。
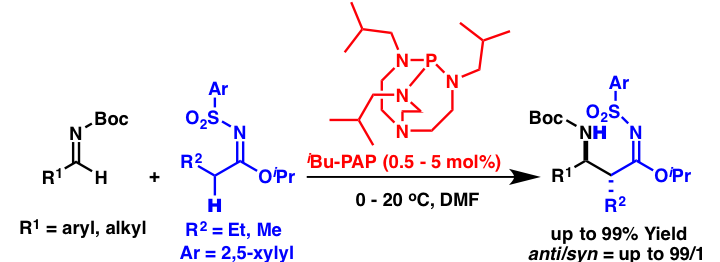
この研究の課程で、α位に活性化基を持たないエステル等価体であるスルホニルイミデートのMannich型反応を報告していますが、その際用いた触媒であるDBUはその触媒活性が低い傾向があり、より高活性な触媒の開発が求められていました。ホスファゼンやホスファトランのようなリン原子を有する有機塩基は有機超強塩基と呼ばれ、窒素原子を中心とする有機塩基に比べて高い塩基性を示すことが知られています。そこで、これらを用いて本反応を行ったところ、iBu-PAPを用いた際にその高い反応性を見いだすことができました。
Topics
- 有機超強塩基を用いるスルホニルイミデートの直接的触媒的Mannich型反応の開発
- 有機超強塩基を用いるスルホニルイミデートの直接的触媒的1,4-付加反応の開発
- 有機超強塩基と水による基質の協働的活性化に基づく触媒的ヘテロ環合成
有機超強塩基を用いるスルホニルイミデートの直接的触媒的Mannich型反応の開発
解説
当研究室では、α位に活性化基を持たないエステル等価体であるスルホニルイミデートのMannich型反応を報告していますが、その際用いた触媒であるDBUはその触媒活性が低い傾向があり、より高活性な触媒の開発が求められていました。ホスファゼンやホスファトランのようなリン原子を有する有機塩基は有機超強塩基と呼ばれ、窒素原子を中心とする有機塩基に比べて高い塩基性を示すことが知られています。そこで、これらを用いて本反応を行ったところ、iBu-PAPを用いた際にその高い反応性を見いだすことができました。また、反応機構について検討を行ったところ、iBu-PAPは反応の初期段階のスルホニルイミデートの脱プロトン化をした後は、反応中間体をプロトン化せず、その反応中間体自体が塩基として次のスルホニルイミデートを脱プロトン化して反応が進行する生成物塩基機構で本反応が進行していることが示唆されました。
論文へのアクセス
- Highly Efficient Organosuperbase-Catalyzed Mannich-Type Reactions of Sulfonylimidates with Imines: Successful Use of Aliphatic Imines as Substrates and a Unique Reaction Mechanism,
- J. Nakano, K. Masuda, Y. Yamashita, S. Kobayashi,
- Angew. Chem. Int. Ed., 51, 9525-9529 (2012). DOI: 10.1002/anie.201204572
有機超強塩基を用いるスルホニルイミデートの直接的触媒的1,4-付加反応の開発
解説
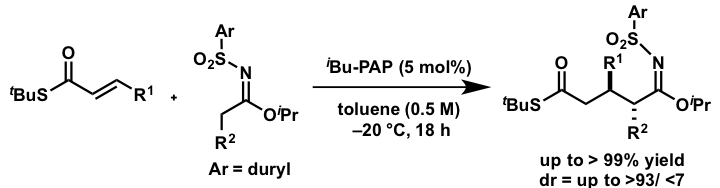
有機量強塩基を用いるスルホニルイミデートの触媒的1,4-付加反応について検討を行いました。α位に活性化基を持たないエステルの直接的触媒的1,4-付加はこれまでに例がなく、その等価体であるスルホニルイミデートの使用は有効であると考えられます。検討を行った結果、求電子剤としてα、βー不飽和チオエステルを用いた際に、反応が高い収率・ジアステレオ選択性で進行することを見いだしました。
論文へのアクセス
- Organosuperbase-catalyzed Direct-type Michael Addition Reactions of Sulfonylimidates as Ester Surrogates,
- K. Masuda, J. Nakano, Y. Yamashita, S. Kobayashi,
- Asian J. Org. Chem., 2, 303-306 (2013). DOI: 10.1002/ajoc.201300014
有機超強塩基と水による基質の協働的活性化に基づく触媒的ヘテロ環合成
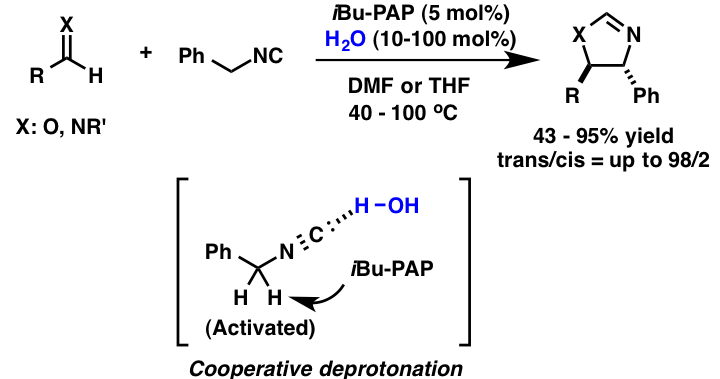
解説
ベンジルイソシアニドとアルデヒドやイミンとの反応による触媒的ヘテロ環合成において、有機超強塩基を用いて検討を行ったところ、水を添加剤として少量共存させた際に、反応の大幅な加速が見られることを明らかにしました。この反応系では、水は有機超強塩基によって脱プロトン化されず、ブレンステッド酸としてイソシアニドを活性化していることがNMR実験より判明しました。この発見は、従来考えられていた水に対する有機超強塩基の反応性の解釈に新たな考えを与えます。
論文へのアクセス
- A Cooperative Water Effect in Proazaphosphatrane-Catalysed Heterocycle Synthesis,
- M. A. Honey, Y. Yamashita, S. Kobayashi,
- Chem. Commun., 50, 3288-3291 (2014). DOI: 10.1039/C3CC49808E