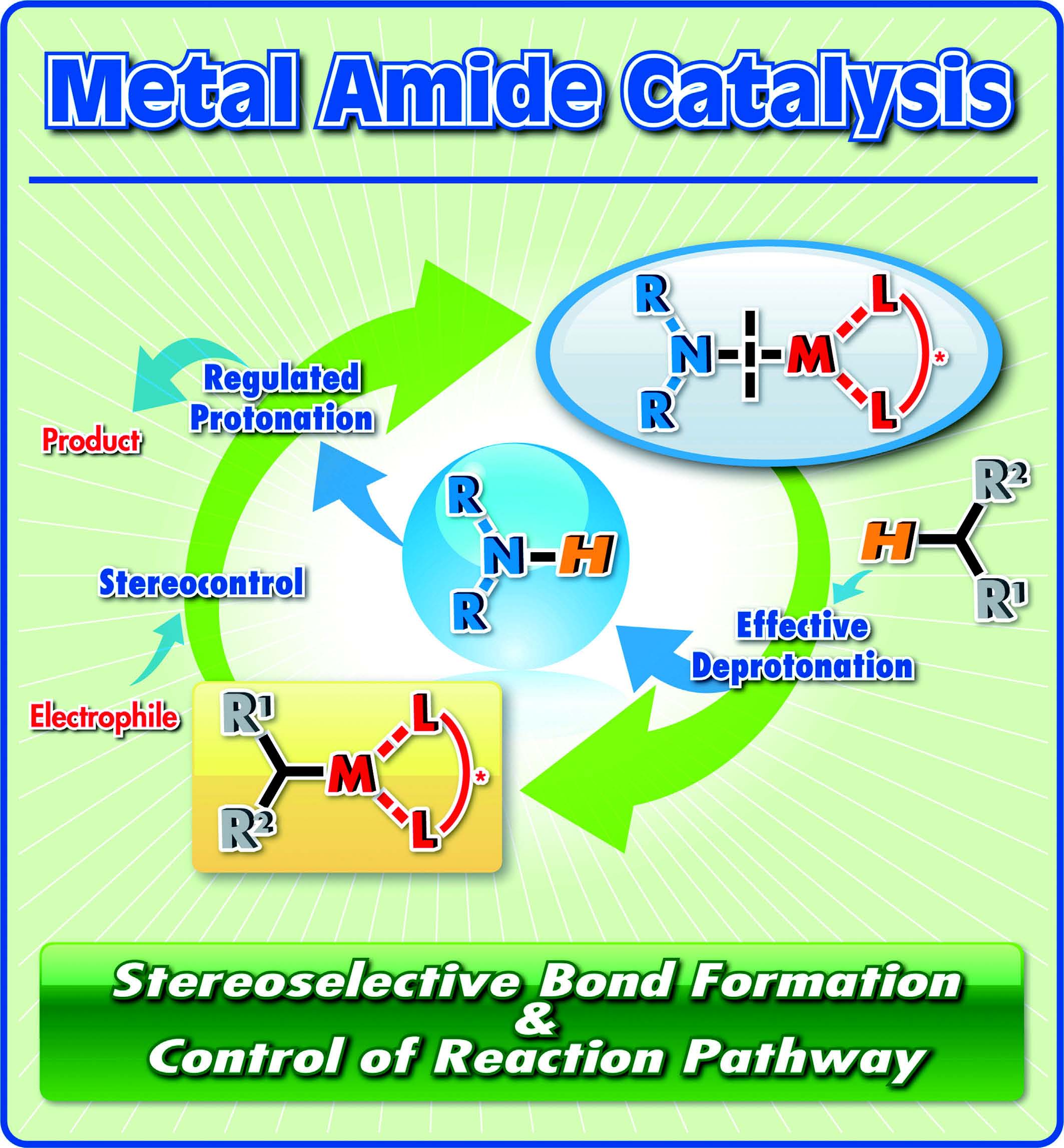
金属アミドを触媒として用いる反応開発
金属アミド化合物は、金属-窒素結合を分子内に有する化合物であり、その窒素部位は窒素アニオン等価体として強い塩基性を発現することが期待できます。この中でも、リチウムジイソプロピルアミド(LDA)やカリウムヘキサメチルジシラジド(KHMDS)に代表されるアルカリ金属アミドは、これまでに化学量論量の強塩基として有機合成化学において汎用されてきました。しかしこれらの金属アミド、特にアルカリ金属以外の金属アミドは、オレフィンのヒドロアミノ化反応等に用いられることはありましたが、触媒として高立体選択的炭素-炭素結合生成反応に積極的に適用された例はほとんどありませんでした。現在筆者らは、この金属アミド種を近接する酸と塩基の二つの活性化点を有する協働機能酸/塩基触媒と位置づけ、そのより強い塩基性を活用する触媒的分子骨格構築反応の開発を行っています。
Review:
- Metal Amides as the Simplest Acid/Base Catalysts for Stereoselective Carbon–Carbon Bond-Forming Reactions,
- Y. Yamashita, S. Kobayashi,
- Chem. Eur. J., 19, 9420-9427(2013). DOI: 10.1002/chem.201300908
Topics
- α-アミノホスホン酸エステルのSchiff塩基を用いる触媒的不斉[3+2]付加環化反応
- キラル銀アミドを用いるα-アミノエステルSchiff塩基を用いる[3+2]付加環化反応
- キラル銅アミドを用いる不斉Mannich型反応
- キラル銅アミドを用いる触媒的不斉[3+2]付加環化反応
- ルイス酸/金属アミドハイブリッド触媒の開発
- 亜鉛アミドを用いる触媒的アリル化反応の開発
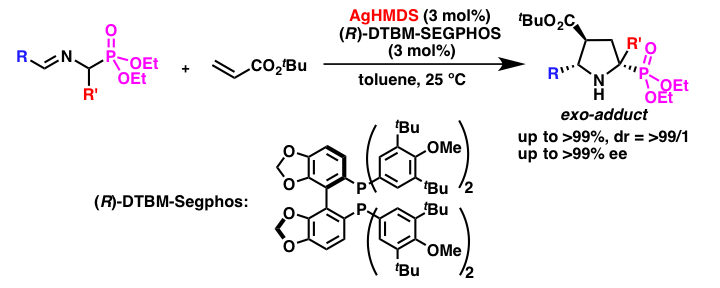
α-アミノホスホン酸エステルのSchiff塩基を用いる触媒的不斉[3+2]付加環化反応
解説
α-アミノホスホン酸エステルのシッフ塩基を用いる[3+2]付加環化反応は、置換プロリンのホスホン酸類縁体を合成する重要な手法ですが、基質であるホスホン酸エステルのシッフ塩基の反応性が低いために、触媒的不斉合成反応への展開はこれまで困難とされていました。種々触媒の検討を行ったところ、銀のアミドを用いることにより、目的とする反応が高立体選択的に進行することを見いだしました。本反応はキラルな銀のアミドを用いる触媒的不斉反応の初の例であります。
論文へのアクセス
- Chiral Silver Amide-Catalyzed Enantioselective [3 + 2] Cycloaddition of α-Aminophosphonates with Olefins,
- Y. Yamashita, X.-X. Guo, R. Takashita, S. Kobayashi,
- J. Am. Chem. Soc., 132, 3262-3263 (2010). DOI: 10.1021/ja100101n
- Chiral Silver Amides as Effective Catalysts for Enantioselective [3+2] Cycloaddition Reactions,
- Y. Yamashita, T. Imaizumi, X.-X. Guo, S. Kobayashi,
- Chem. Asian J. , 6,, 2550-2559 (2011). DOI: 10.1002/asia.201100246
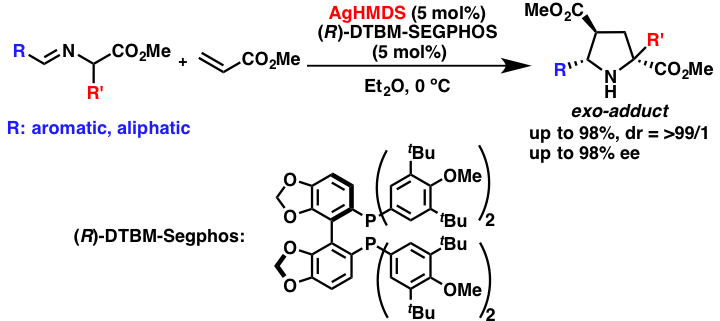
キラル銀アミドを用いるα-アミノエステルSchiff塩基を用いる[3+2]付加環化反応
解説
キラル銀アミド触媒は、α-アミノエステルのシッフ塩基を用いる[3+2]付加環化反応にも適用できます。本反応は、これまでに様々な触媒を用いて行われて来ましたが、exo選択的な反応の成功例は少なく、また反応性の低い脂肪族アルデヒド由来のSchiff塩基を基質としては用いた例はあまりありませんでした。本キラル銀アミド触媒系は、その様な反応性の低い基質も活性化することができ、目的とする反応が高立体選択的に進行させます。
論文へのアクセス
- Chiral Silver-Amide Catalyst for the [3 + 2] Cycloaddition of a-Amino Esters to Olefins,
- Y. Yamashita, T. Imaizumi, S. Kobayashi,
- Angew. Chem. Int. Ed., 50, 4893-4896 (2011). DOI: 10.1002/anie.201008272
- Chiral Silver Amides as Effective Catalysts for Enantioselective [3+2] Cycloaddition Reactions,
- Y. Yamashita, T. Imaizumi, X.-X. Guo, S. Kobayashi,
- Chem. Asian J. , 6,, 2550-2559 (2011). DOI: 10.1002/asia.201100246
キラル銅アミドを用いる不斉Mannich型反応
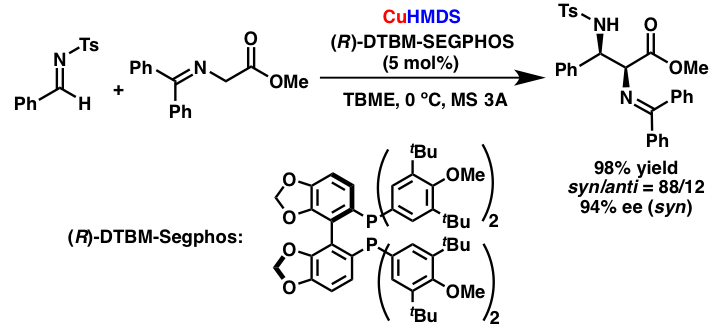
解説
銅アミドの不斉触媒化を指向し、キラル銅アミドを用いるグリシンSchiff塩基とイミンとの不斉Mannich型反応の検討を行いました。嵩高い配位子であるDTBM-Segphosを用いることにより、高い不斉収率で目的の反応が進行することを見出しました。本反応は、キラル銅アミドを用いる高立体選択的触媒的不斉反応の初の例です。
論文へのアクセス
- Chiral Copper Amide-Catalyzed Asymmetric Mannich-Type Reactions of Glycine Schiff Base,
- Y. Yamashita, S. Yoshimoto, K. Masuda, S. Kobayashi,
- Asian J. Org. Chem., 1, 327-330 (2012). DOI: 10.1002/ajoc.201200092
キラル銅アミドを用いる触媒的不斉[3+2]付加環化反応
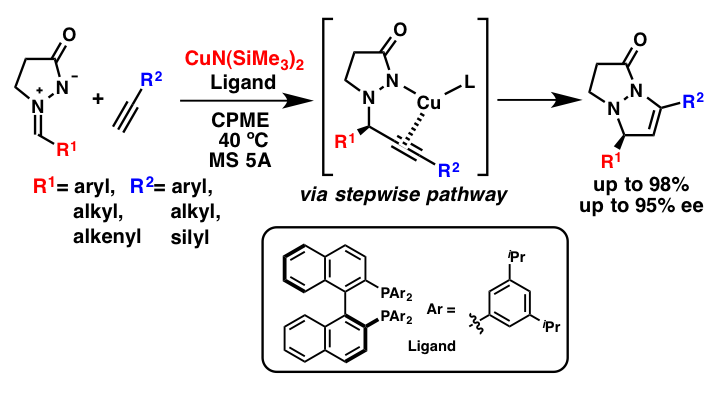
解説
銅アミド触媒を用いることで、アゾメチンイミンと末端アルキンの1,3-双極子環化付加反応が進行し、二環性のピラゾリジノン誘導体が得られることを見いだしました。さらにキラル配位子を添加することで、触媒的不斉合成も達成しました。この反応は高い収率、高い位置選択性、高いエナンチオ選択性で進行します。反応機構の考察から、この反応はアルキンの付加反応及び分子内環化反応が逐次的に進行していると推測され、この逐次反応を進行させるためには、金属アミドの共役酸である二級アミンの酸性度の低さが鍵となっていることが分かりました。
論文へのアクセス
- Group 11 Metal Amide-Catalyzed Asymmetric Cycloaddition Reactions of Azomethine Imines with Terminal Alkynes,
- T. Imaizumi, Y. Yamashita, S. Kobayashi,
- J. Am. Chem. Soc., 134, 20049-20052 (2012). DOI: 10.1021/ja311150n
ルイス酸/金属アミドハイブリッド触媒の開発
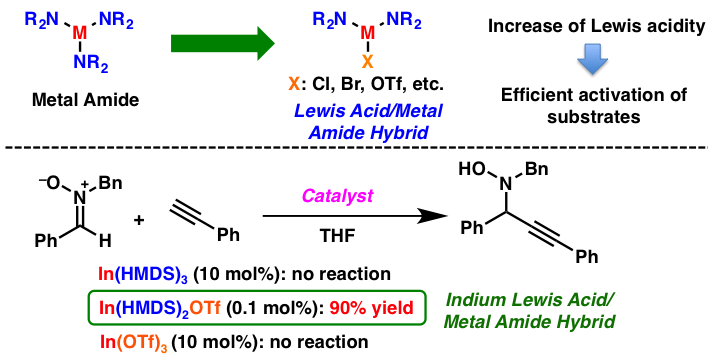
解説
ルイス酸および金属アミドは有機合成化学で汎用される試薬ですが、これらの機能を両方持つ化学種は、お互いの活性を損ない合ってしまい不活性であるとこれまで考えられていました。今回その常識に反し、金属アミドに電子求引性の対アニオンを導入することにより、金属のルイス酸性を高めた金属アミド、“ルイス酸/金属アミドハイブリッド触媒を開発しました。インジウムを金属中心として用いた場合、ニトロンに対するアルキンの付加反応が、インジウムアミドやインジウムルイス酸では進行しない一方で、インジウムルイス酸/金属アミドハイブリッド種を用いた場合のみ、高い収率で反応が進行することを見出しました。この概念は、他金属や他反応にも適用することができます。
論文へのアクセス
- A Lewis Acid/Metal Amide Hybrid as an Efficient Catalyst for Carbon–Carbon Bond Formation,
- Y. Yamashita, Y. Saito, T. Imaizumi, S. Kobayashi,
- Chem. Sci., 5, 3958-3962 (2014). DOI: 10.1039/C4SC01332H
亜鉛アミドを用いる触媒的アリル化反応の開発
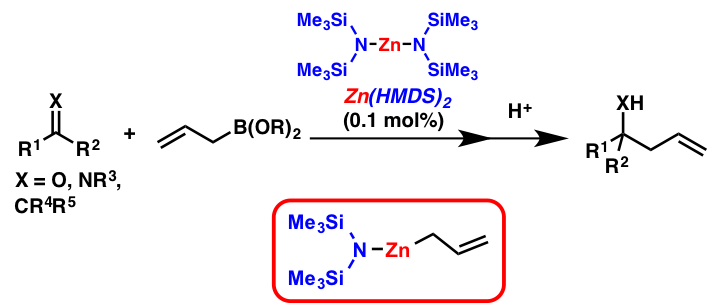
解説
金属アミドは通常ブレンステッド塩基として用いられることが主ですが、これをルイス酸/ルイス塩基触媒として活用する例はほとんど知られていませんでした。筆者らは、金属アミドを触媒として用いる分子骨格構築反応の開発において、亜鉛アミドがアリルホウ酸エステルとケトンとの触媒的アリル化反応を高効率的に進行させることを見出しました。本反応は、亜鉛アミドとアリルホウ酸エステルとの金属交換反応を鍵段階として進行しており、NMR実験においてアリル亜鉛アミドの円滑な生成が確認されています。また、不斉配位子を用いることにより、本反応を触媒的不斉反応へと展開することも可能です。
論文へのアクセス
- Facile Preparation of Allylzinc Species from Allylboronates and Zinc Amide via Boron-to-Zinc Exchange Process and their Reactions with Carbonyl Compounds, Imines and Hydrazones,
- Y. Cui, Y. Yamashita, S. Kobayashi,
- Chem. Commun., 48, 10319-10321 (2012). DOI: 10.1039/C2CC34340A
- Catalytic Use of Zinc Amide for Transmetalation with Allylboronates: General and Efficient Catalytic Allylation of Carbonyl Compounds, Imines, and Hydrazones,
- Y. Cui, W. Li, T. Sato, Y. Yamashita, S. Kobayashi,
- Adv. Synth. Catal., 355, 1193-1205 (2013). DOI: 10.1002/adsc.201201134