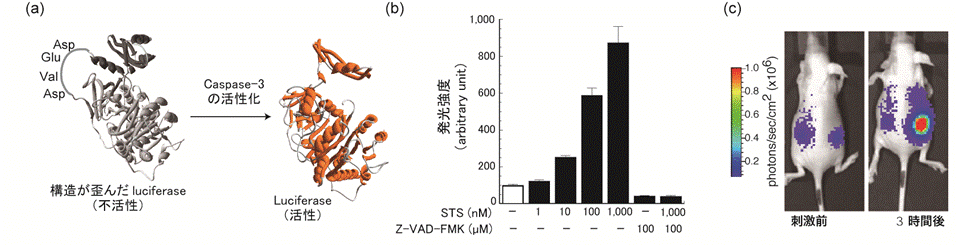
環状ルシフェラーゼを用いたプロテアーゼ活性のイメージング
細胞内ではシグナル伝達にペプチド切断酵素−プロテアーゼが利用されています. 例えば,細胞死(アポトーシス)におけるシグナル伝達や,ヒト免疫不全ウィルスの増殖が代表例です. これらシグナルは細胞機能を調節する上で重要な役割を担っており,現在プロテアーゼを標的とした薬剤開発が進められています. ここではアポトーシスの重要なチェックポイントとして機能するcaspase-3プロテアーゼ活性を,ルシフェラーゼを利用して可視化する方法について紹介します.
ペプチド切断酵素Caspase-3は,標的タンパク質に含まれるAsp-Glu-Val-Aspの4アミノ酸を特異的に認識し切断します. この4アミノ酸を,ルシフェラーゼのN末端とC末端の間に挿入し,環状化したluciferaseを形成します.N末とC末の連結には,DnaE間のプロテインスプライシングを利用します.即ちluciferaseの両末端にDnaEを連結します.このタンパク質を細胞内に発現すると,DnaE間で相互作用がおこり,自発的に環状luciferaseが形成されます.環状luciferaseは,立体構造に歪みが生じるため, その活性が低下あるいは完全に失われます.この不活性なluciferaseをCOS7細胞に発現させ,細胞内に蓄積させておきます. もし細胞内でcaspase-3が活性化すると,環状luciferase中のAsp-Glu-Val-Asp配列が切断され,luciferaseは元の立体構造に戻ります. すなわちluciferaseの発光能が回復します.実際,細胞にアポトーシスを誘起するstaurosporine (STS)を添加すると, STS濃度依存的に発光シグナルが上昇します.また,caspase-3の阻害剤であるZ-VAD-FMKを投与すると,発光シグナルの上昇は抑制されることから,阻害剤評価に応用可能であることがわかりました.また環状luciferaseをマウス個体に発現させると, 生きたマウス個体内におけるアポトーシスの時間変化を検出することも可能です.Caspase-3の認識配列Asp-Glu-Val-Aspを,他のプロテアーゼ認識配列に変えれば,標的とするプロテアーゼ活性を評価できる一般性を有しています.